TRANSFERENCIA DE MASA, APLICACIONES
Fundamentos de la difusión y la transferencia de masa entre fases.
Las operaciones de transferencia de masa son esenciales en la industria química, ya que prácticamente todos los procesos requieren, en algún momento, la purificación de materias primas, productos intermedios o la separación de productos finales de sus subproductos. Estas operaciones suelen estar acompañadas de transferencia de calor y flujo de fluidos, formando un conjunto integral en los procesos químicos.
La transferencia de masa tiene aplicaciones en diversas industrias, como la producción de fertilizantes, la industria azucarera, la fabricación de ácidos como el sulfúrico y el clorhídrico, y en refinerías de petróleo. Estas operaciones se distinguen por el movimiento de una sustancia a escala molecular a través de otra. En este contexto, se estudiarán tanto las leyes fundamentales que rigen estos fenómenos como los equipos principales utilizados en dichos procesos.
¿Qué es la transferencia de masa?
La transferencia de masa se refiere al movimiento de uno o más componentes dentro de una mezcla, que ocurre desde una región con alta concentración hacia otra con menor concentración. Un ejemplo común es cuando se introduce un cristal de sulfato cúprico en agua. Al disolverse, el agua alrededor del cristal adquiere una coloración azul más intensa cerca de la superficie del cristal. Con el paso del tiempo, este color azul se extiende hacia las zonas más alejadas, mientras el cristal se disuelve gradualmente, hasta que toda el agua adquiere un tono azul uniforme.
En este proceso, el sulfato cúprico se desplaza desde la región donde su concentración es mayor hacia áreas con menor concentración. Este fenómeno ocurre debido a la diferencia de concentración entre las regiones, lo que actúa como la fuerza motriz que impulsa la transferencia de masa. Así, este principio explica cómo los componentes se distribuyen en una mezcla en respuesta a un gradiente de concentración.
Equilibrio en la transferencia de masa
La transferencia de masa tiene un límite conocido como equilibrio entre fases, el cual se alcanza cuando ya no hay una fuerza motriz que impulsa el proceso, y la transferencia neta se detiene. Físicamente, este equilibrio se produce de la siguiente manera: si tenemos una fase gaseosa y una fase líquida, y el componente que se transfiere inicialmente está presente solo en la fase gaseosa con una concentración 𝑦, mientras que en la fase líquida la concentración es incógnita=0, al entrar ambas fases en contacto, las moléculas del componente comienzan a moverse desde la fase gaseosa hacia la líquida. La velocidad de transferencia en este caso es proporcional a la concentración del componente en la fase gaseosa.
A medida que el componente comienza a acumularse en la fase líquida, también ocurre el fenómeno inverso: las moléculas del componente pasan de la fase líquida a la gaseosa con una velocidad proporcional a la concentración en la fase líquida. Con el tiempo, la velocidad de transferencia de la fase gaseosa a la líquida disminuye, mientras que la velocidad inversa (de la líquida a la gaseosa) aumenta. Eventualmente, ambas velocidades se igualan, estableciendo un equilibrio dinámico entre las fases. En este punto, la transferencia neta del componente es nula, aunque las moléculas siguen moviéndose entre las fases de manera continua.
Es importante destacar que la diferencia de concentraciones entre las fases (incógnita−y) no es la fuerza motriz del proceso. La verdadera fuerza motriz es el alejamiento de las concentraciones respecto a sus valores de equilibrio. Esto puede expresarse como (incógnita−incógnita ∗) o (y−y∗), dependiendo del caso. A este punto, las concentraciones alcanzan una relación específica llamada "dependencia de equilibrio", que está determinada por las condiciones de temperatura y presión.
Un ejemplo típico de equilibrio en transferencia de masa ocurre en una botella de refresco carbonatado. Antes de abrir la botella, el dióxido de carbono (CO2) está en equilibrio entre la fase líquida (disuelto en el refresco) y la fase gaseosa (dentro del espacio vacío de la botella). Cuando la botella se agita y se abre, el equilibrio se rompe porque la presión disminuye restrictivamente. Esto provoca que el CO2 disuelto comienza a salir de la fase líquida hacia la fase gaseosa, restableciéndose un nuevo equilibrio a la presión atmosférica. Este comportamiento ilustra cómo las concentraciones equilibradas dependen de la presión y la temperatura.
Absorción:
La absorción es un proceso en el cual un gas o vapor se disuelve en un líquido, pasando de la fase gaseosa a la líquida. Este proceso implica una transferencia de masa entre las dos fases, donde las moléculas del gas son capturadas por el líquido debido a una diferencia de concentración. La absorción está influenciada por factores como la solubilidad del gas en el líquido, la temperatura, la presión y el aire.
Desorción
La desorción es el proceso inverso a la absorción, en el cual una sustancia que previamente había sido absorbida o adsorbida por un material o fase se libera de nuevo a la fase gaseosa. Este fenómeno ocurre cuando las condiciones de temperatura, presión o concentración se modifican de tal manera que la sustancia liberada es expulsada del líquido o sólido que la había retenido. La desorción puede ser un proceso natural o inducido, y generalmente implica un aumento en la energía del sistema, como el aumento de temperatura, para facilitar la liberación de la sustancia.
Este proceso se utiliza combinado en aplicaciones industriales, como en la regeneración de adsorbentes en sistemas de purificación de gases o líquidos. En estos casos, los contaminantes capturados por un material adsorbente son liberados para poder reciclar el adsorbente o eliminar los contaminantes de manera eficiente. La desorción es un paso clave en muchos procesos de separación y purificación, permitiendo la recuperación de sustancias valiosas o la eliminación de impurezas de una corriente de gas o líquido.
Destilación
La destilación es un proceso de separación de componentes de una mezcla líquida basada en las diferencias en sus puntos de ebullición. Consiste en calentar una mezcla hasta que uno o más de sus componentes se evaporen, luego condensar el vapor para separarlo del líquido restante. Este proceso se utiliza para purificar líquidos, separar compuestos de una mezcla o concentrar una sustancia. La eficiencia de la destilación depende de la diferencia de volatilidad entre los componentes de la mezcla, es decir, de qué tan fácilmente cada componente pasa de líquido a vapor a una temperatura determinada.
Existen diferentes tipos de destilación, como la destilación simple, fraccionada, al vacío y azeotrópica, que se eligen dependiendo de la naturaleza de la mezcla a separar. En la destilación fraccionada, por ejemplo, se utiliza una columna de fraccionamiento para separar los componentes en función de sus puntos de ebullición, lo que permite obtener productos más puros. Este proceso es ampliamente utilizado en la industria química, petroquímica, farmacéutica, y en la producción de bebidas alcohólicas, entre otras.
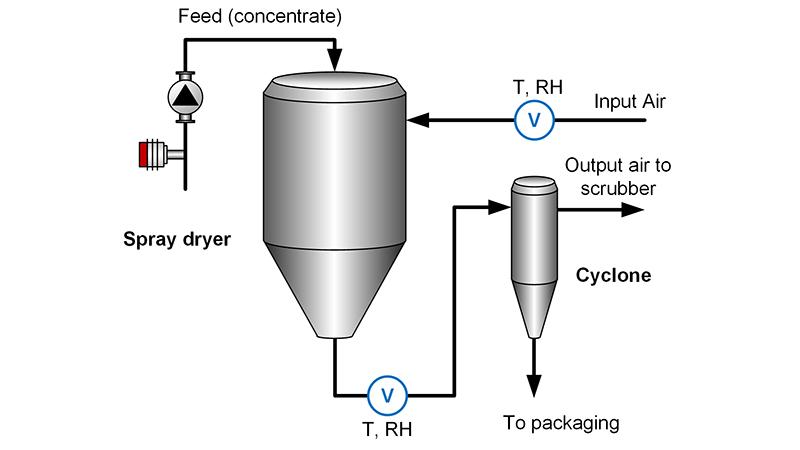
Secado
El secado es el proceso mediante el cual se elimina la humedad o el agua contenida en un material, generalmente mediante la aplicación de calor. Este proceso se utiliza para reducir la cantidad de agua en una sustancia, ya sea para conservarla, mejorar sus propiedades o facilitar su posterior procesamiento. Durante el secado, el agua se evapora de la superficie del material, y en algunos casos, también se extrae agua interna. El proceso de secado puede llevarse a cabo utilizando diferentes técnicas y equipos, como secadores por aire caliente, secado al vacío, o secado mediante calor radiante.
El secado es una operación común en diversas industrias, como la alimentaria, farmacéutica, textil y de materiales, ya que ayuda a evitar el tratamiento microbiológico y mejorar la estabilidad de los productos. Además, es un proceso fundamental en la producción de productos como granos, hierbas, productos lácteos, y materiales como la madera o el papel, los cuales requieren la reducción de humedad para su conservación o uso posterior.
Lixiviación
La lixiviación es un proceso de separación y extracción de sustancias solubles de un material sólido mediante el uso de un líquido, generalmente agua o una solución química. En este proceso, el solvente penetra en el material sólido, disolviendo los componentes solubles, que luego son separados del sólido. La lixiviación se utiliza en diversas industrias, como la minería, para extraer metales valiosos de los minerales, o en la agricultura, para extraer productos químicos de plantas o suelos.
El proceso de lixiviación puede realizarse de diversas formas, dependiendo del material y la sustancia a extraer. Existen lixiviaciones en pilas, donde el líquido se rocía sobre un montón de material, o en columnas, donde el material se coloca en una torre y se lava con el solvente. En la minería, por ejemplo, la lixiviación de minerales como el oro o el cobre implica el uso de soluciones químicas que disuelven estos metales, facilitando su extracción y posterior purificación.
Extracción
La extracción es un proceso de separación de un componente deseado de una mezcla utilizando un disolvente. Este proceso se basa en la solubilidad diferencial de los componentes de la mezcla en el disolvente, permitiendo que el componente objetivo se disuelva y se separe del resto de la mezcla. La extracción se puede realizar con diversos disolventes, que pueden ser líquidos, sólidos o una combinación de ambos, y se emplea en numerosas industrias, como la farmacéutica, alimentaria y química.
Existen dos tipos principales de extracción: la extracción líquido-líquido, donde se utiliza un disolvente líquido para extraer una sustancia de otra fase líquida, y la extracción sólido-líquido, que se emplea para separar compuestos solubles de un sólido utilizando un disolvente. La eficiencia del proceso depende de factores como la elección del cartucho, la temperatura, el tiempo de contacto y la agitación. La extracción es fundamental en la producción de aceites esenciales, la purificación de productos químicos y la obtención de compuestos naturales a partir de plantas o minerales.
Intercambio iónico
El intercambio iónico es un proceso en el que los iones de una solución son intercambiados con iones de un material sólido, grandes resinas o minerales con capacidad para captar y liberar iones. Este proceso ocurre cuando los iones de una solución pasan a un medio sólido que contiene iones fijos. Los iones presentes en el sólido se liberan a la solución, mientras que los iones de la solución son adsorbidos por el material sólido, logrando así un equilibrio entre ambos. Es un proceso reversible, lo que significa que los iones pueden ser intercambiados varias veces.
Este proceso se utiliza ampliamente en aplicaciones como la purificación de agua, donde los iones contaminantes, como calcio, magnesio, sodio o nitratos, son removidos o intercambiados por iones inofensivos, como sodio o hidrógeno, utilizando resinas de intercambio iónico. También es fundamental en la industria química y farmacéutica para la purificación y separación de compuestos, y en la industria de ablandamiento de agua, donde se eliminan los iones responsables de la dureza del agua, como los iones de calcio y magnesio.
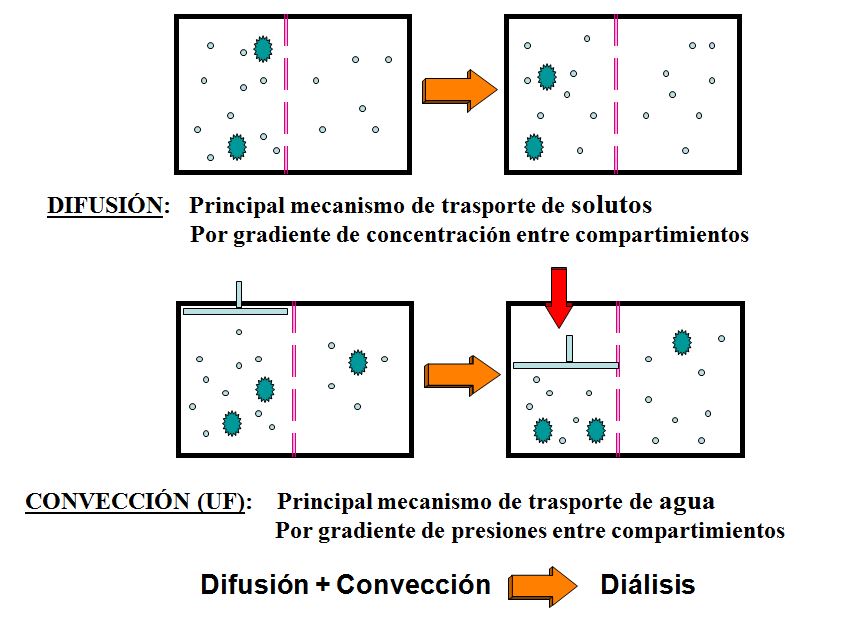
Difusión por convección
La difusión por convección es un proceso de transferencia de masa en el que los componentes de una mezcla se desplazan debido a la combinación de la difusión molecular y el movimiento de un fluido, generalmente un gas o líquido. En este caso, la convección, que implica el transporte de partículas debido al flujo del fluido, facilita la difusión de los componentes a través del medio. La difusión molecular es el proceso por el cual las moléculas se mueven de una zona de alta concentración a una de baja concentración debido a sus movimientos aleatorios, mientras que la convección amplifica este proceso al crear un movimiento global del fluido, acelerando la dispersión de los componentes.
Este fenómeno se puede observar en muchas aplicaciones, como en los intercambiadores de calor, donde el fluido en movimiento mejora la transferencia de calor y masa entre las fases. La combinación de la difusión y la convección también es importante en procesos de ventilación, en la distribución de contaminantes en la atmósfera o en sistemas biológicos como la circulación sanguínea, donde el movimiento del fluido acelera el intercambio de gases como el oxígeno y el dióxido de carbono.
Bibliografía
Arce, M. (2015). Fundamentos de la transferencia de calor y masa . Editorial
García, J., & Pérez, L. (2018). Procesos industriales de separación .
Hernández, R. (2017). Operaciones unitarias en la ingeniería química . McGraw-Hill.
López, S., & Martínez, F. (2019). Principios de la termodinámica aplicada a los
procesos industriales . Editorial Académica
Pérez, C., & Ramírez, G. (2016). Intercambio iónico en procesos industriales .
Rodríguez, M. y Torres, E. (2020). Procesos de purificación en la industria química .
Sánchez, J., & López, P. (2017). Extracción y lixiviación en la minería moderna .
Salazar, V., & Díaz, A. (2015). Secado de materiales en la industria alimentaria.
Vásquez, R. (2018). Destilación y otros procesos de separación .









Comentarios
Publicar un comentario